Antoine Lavoisier foi un químico francés, naceu en París el 26 de agosto do ano 1743, e morreu o 8 de maio do 1794 tamen en París, non exactamente de morte natural como despois veremos.
Estudou cosas tan interesantes como a oxidación dos corpos, o fenómeno da respiración animal, analizou o aire, e estableceu a Lei de conservación da masa, entre outas cousas.
Vamos a pasar a facer unha resumida biografía da vida de Lavoisier.
Como xa dixemos antes, Lavoisier naceu en París no ano 1743. O seu pai era avogado e conselleiro parlamentario, vamos que Lavoisier naceu nunha familia acomodada, polo que recibiu unha boa educación.
-No ano 1764 acaba a carreira de dereito, pero el sempre se sentira mais atraído pola ciencia.
-No 1765 recibe a medalla de ouro da 'Academia ótica industria da pólvora', por este motivo desplazase ó arsenal de París, onde monta un bo laboratorio.
-En 1768 é admitido na 'Academia Francesa' e foi escalando ata chegar a ser director no ano 1875 e tesoreuro no ano 1791. É nombrado asistente nun dos departamentos recaudadores de impostos e mais tarde membro titular da principal agencia recaudadora de impostos.
-No 1770 faise famoso ó demostrar que non era certa a creenza de que a auga podia convertirse en terra destilando a auga, demostrouno pesando de maneira moi precisa o residuo sólido e o aparato de destilación, e descubriu que o sólido prodecia do recipiente e non da auga.
-Un ano despois, no ano 1771 casouse con Marie Paulze. A dote permitiulle instalar un laboratorio moi grande, e ela axudarialle por exemplo na ilustración dos seus experimentos.
-No 1772 o seu pai comproulle un título de nobreza (algo bastante típico naquelas fechas) . Neste mesmo ano afirmou que o fósforo e o azufre aumentan de peso cando se queman porque absorven aire.
-Neste ano, o 1773 publica o seu primeiro libro, cuxo título é 'Opúsculos Físicos e Químicos'
-No ano 1775 é nombrado director da administración da pólvora.
-No 1777 deulle ó aire desflogisticdo o actual nome de osíxeno
-Xa un cantos anos despois, no 1783 anunciou á Academia que a auga é oresultado da combinación do hidróxeno có osíxeno.
-No ano 1785 é nombrado membro do comité gubernamental sobre agricultura, e escribiu informes sobre cultivos e algúns esquemas agrícolas.
-No ano 1787 xunto cun grupo de químicos franceses publica o método de nomenclatura química, que clasificou e renombrou os elementos e compostos daquelas coñecidos. Como terratenente da provincia de Orleans, foi escollido membro da asamblea provinciaal.
-Con outros químicos, no 1788, crea os 'Informes de química', unha revista adicada á química.
-No ano 1789 publica o seu 'Tratado elemental de química'.Neste tratado definiu como elementos aquelas substancias que non poden convertirse noutras mais simples. Neste tratado tamén estableceu a sua ley de conservación da masa dicindo ''Nada se crea ou se destrue, solo hai alteraciones e modificaciones e hai unha cantidade de masa antes e despois da operación''.Neste ano comezou a revolución francesa e el participou, e cando se reuniron os Estados Xenerales, foi diputado e elaborou un codigo de instrucciones para guía de los diputados.
-No 1790 foi nombrado secretario e tesoreiro da comisión para asegurar a uniformidade de pesos e medidas en toda Francia, o que levou ó establecemento do sistema métrico.
-No 1791 perdeu a sua posición como administrador da pólvora e onligaronlle a abandoar o arsenal.Jean Paul Marat acusouno.
-No ano 1793 suprimiuse a Academia das ciencias, e Marat un cabecilla revolucionario da revolución francesa, acusou a Lavoisier de complots absurdos e esixiu a sua morte. Ainda que Marat morreu asesinado en xullo do 1793 o que el dixera seguiuse a ter en conta.Creese que Marat atacoua Lavoisier porqu este desacreditara un tratado de Marat.
-En 1794 despois dun xuizo non moi xusto, xa que durou menos dun día, un tribunal revolucionario condenou a morte a Lavoisier e a outros 27 a pena de morte.Esa mesma tarde foi guillotinado, e o seu corpo foi arroxado a unha fosa común.
Como vedes a vida de Lavoisier foi interesante, aínda que non rematou moi ben....
Espero que vos agradara esta entrada. Daniel Meira
 As baterías recargables son dispositivos que almacenan enerxía eléctrica, que non é o mesmo que producen enerxía eléctrica, xa que as baterías non poden funcionar se non se cargaron con enerxía eléctrica. Digamos que as baterías son para os aparatos eléctricos que as utilizan como nos usamos as despensas; nos temos que ir ó supermercado, compramos o que precisamos, e logo o metemos na despensa. Nas baterías igual. Cárganse con enerxía eléctrica, que devolven logo case na súa totalidade.
As baterías recargables son dispositivos que almacenan enerxía eléctrica, que non é o mesmo que producen enerxía eléctrica, xa que as baterías non poden funcionar se non se cargaron con enerxía eléctrica. Digamos que as baterías son para os aparatos eléctricos que as utilizan como nos usamos as despensas; nos temos que ir ó supermercado, compramos o que precisamos, e logo o metemos na despensa. Nas baterías igual. Cárganse con enerxía eléctrica, que devolven logo case na súa totalidade.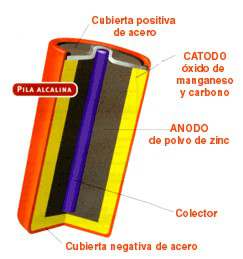
 Actualmente, as baterías recargables máis usadas son as baterías de ións de litio ou Li-Ion, grazas a que non sufren o "efecto memoria" e, comparadas coas de outros materiais como o plomo ou o cadmio, cos que se fan tamén baterías recargables, son moito máis rentables, xa que con menos masa prodúcese máis enerxía. Ademáis, as baterías feitas con outros materiais sufren o chamado efecto memoria, que consiste en que se a batería aínda non se esgotou o 100% ( digamos que aína lle queda un 10%), ó recargala, non se recargara o 100% (neste caso recargaríase ata o 90%) , polo que cada vez duraría menos tempo. Outra vantaxe que teñen este tipo de baterías é que , o producir máis enerxía con menos masa, son máis lixeiras, e poden usarse, por exemplo en reproductores de mp3 , e aparatos de ese estilo que non precisan cantidades elevadas de enerxía.
Actualmente, as baterías recargables máis usadas son as baterías de ións de litio ou Li-Ion, grazas a que non sufren o "efecto memoria" e, comparadas coas de outros materiais como o plomo ou o cadmio, cos que se fan tamén baterías recargables, son moito máis rentables, xa que con menos masa prodúcese máis enerxía. Ademáis, as baterías feitas con outros materiais sufren o chamado efecto memoria, que consiste en que se a batería aínda non se esgotou o 100% ( digamos que aína lle queda un 10%), ó recargala, non se recargara o 100% (neste caso recargaríase ata o 90%) , polo que cada vez duraría menos tempo. Outra vantaxe que teñen este tipo de baterías é que , o producir máis enerxía con menos masa, son máis lixeiras, e poden usarse, por exemplo en reproductores de mp3 , e aparatos de ese estilo que non precisan cantidades elevadas de enerxía.


 A constante dos gases universales, ven dicir que se un gas que se atopa en certas condicións (que veremos máis abaixo), podemos multiplicar a súa presión polo seu volume e nos va a dar o mesmo que se multiplicamos o número de moles que temos nese volumen pola temperatura á que se atopa o gas por R (xa veremos tamén máis abaixo o que é R).
A constante dos gases universales, ven dicir que se un gas que se atopa en certas condicións (que veremos máis abaixo), podemos multiplicar a súa presión polo seu volume e nos va a dar o mesmo que se multiplicamos o número de moles que temos nese volumen pola temperatura á que se atopa o gas por R (xa veremos tamén máis abaixo o que é R).